GMP、GSP取消认证?药品监管不再严格?你想多了
从药品管理法修正案发布以来,关于GMP认证取消的事情一直接连不断,成了行业内人的饭后茶谈,难道GMP是真的要取消认证了吗?那以后GMP检查应该怎么做呢?一系列的问题逐条而出。
所以,这到底是怎么一回事呢?
GMP:药品生产质量管理规范
全称:Good Manufucturing Practice
GSP:药品经营质量管理规范
全称:Good Supply Practice
MAH:药品上市许可持有人制度
全称:Marketing Authorization Holder
去年,由于疫苗问题,药品管理法修正草案提交全国人大常委会审议,草案围绕问题疫苗案件暴露的突出问题,修订相关法条,落实企业主体责任和监管部门监管责任,旨在完善统一权威的药品监管体制和制度。
其中,GMP、GSP认证拟取消、对生产、销售假药重罚、强化全过程监管、实施药品上市许可持有人制度,成为草案修订的几大亮点。
此次草案明确写入了“药品上市许可持有人制度”,同时删除了药企的药品生产质量管理规范(GMP)认证、药品经营质量管理规范(GSP)认证,并将药物临床试验机构由许可管理改为备案管理。
这一法案发布,的确是明确写出了删除了GMP和GSP认证,所以导致了有很多没有仔细了解的人认为GMP就要取消了。
实际上,GMP是药品生产的基本要求,只会不断的改善,不会取消,取消的只是认证证书。所谓认证,是指由认证机构证明产品、服务、管理体系符合相关技术规范的强制性要求或者标准的合格评定活动。现有的GMP认证证书,由药品监管部门颁发,有效期5年,从某种角度来讲,就等于监管部门认可,该生产企业在5年内,其生产活动符合GMP规范。

第一,为什么要取消发GMP证书?因为明确写了要加入“MAH(上市许可持有人制度)”了,药品生产质量的第一负责人,由生产厂家,变更为了上市许可人。上市许可人,有责任和义务,督促相关的生产厂家,保证产品质量,如果还是发放GMP证书,那么会弱化掉上市许可人的质量管理职责,所以取消掉会更加明确上市许可人的质量职责。
第二,取消掉药监部门发证,不代表药监部门就取消了对生产企业的检查,MAH制度落地时的核查以及按照第64条,建立了职业化的检查员队伍后,飞检的增加,监管力度实际上没有降低,而是更加加强了。很多人认为取消发证后,监管力度会降低,其实这是不可能发生的。
较为后,GMP其实就是企业的日常活动,其中文名称上文也提到了,是药品生产质量管理规范,所以企业每天都应该按照规范来管理药品的生产质量。并不是今天符合GMP规范,明天就一定就还会符合。有一些企业,认证前认证后是两张脸,检查官一离开,马上就不按规范作业,这就让认证证书变成了违规操作的“遮羞布”。所以,有些国家只有GMP现场检查,没有GMP认证,如美国的FDA,现场检查结束不会颁发GMP证书,只会提供一份EIR报告。但是现在,没有了GMP证书,发现违规,直接吊销药品生产许可证,直接把你赶出行业这个大舞台,这个威慑力度,会比取消GMP认证用处更大。

对于中国当下的药品监管来说,GMP认证的取消在更大程度上是一个具有象征意义的符号。它标志着相关政府部门监管职能的转变与监管思路的理清。
笔者从网上找了一些行业内人士对于取消GMP认证的评论,可以更直白的让人了解。请看↓


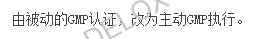



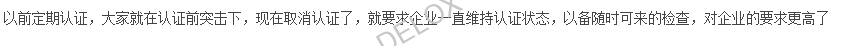
实际上,取消GMP认证,对制药行业反而要求更严格了。未来国家更加注重全过程监管。如药品管理法修正草案明确了药品质量安全追溯要求,药品上市许可持有人、生产经营企业、医疗机构应当建立、实施严格的追溯制度,保证全过程数据真实、准确、完整和可追溯。如在疫苗的研制、生产、流通、预防接种过程中应当采用信息化手段采集、留存追溯信息。
